Nützliches CO2 für Gewächshäuser und die Chemische Industrie
1. Nutzung des CO2 durch Photosynthese
Die Photosynthese ist die natürliche Erzeugung von energiereichen Biomolekülen aus energieärmeren Stoffen mithilfe von Lichtenergie. Sie wird von Pflanzen, Algen und einigen Bakterien betrieben. Bei diesem biochemischen Vorgang wird zunächst mit Hilfe des lichtabsorbierenden Farbstoffes ( Chlorophyll) Lichtenergie in chemische Energie umgewandelt. Diese wird dann unter anderem zum Aufbau energiereicher organischer Verbindungen – sehr oft Kohlenhydrate (Summenformel CH2O) genutzt. Die Gesamtreaktion der Photosynthese mit Wasser als Reduktionsmittel kann durch die folgende allgemeine, vereinfachte Summengleichung formuliert werden:
C O 2 + 2 H 2 A → L i c h t < C H 2 O > + 2 A + H 2 O {displaystyle mathrm {CO_{2}+2;H_{2}A {xrightarrow {Licht}}{}<!CH_{2}O!>+ 2;A+H_{2}O} } CO2 + H2O = <CH2O> + O2. Reaktion unter Einfluß von Licht oder:
6 CO2 + 6 H2O = C6H12O6 + 6 O2 + 2870 KJ/mol
Oder in Worten:
Aus Kohlenstoffdioxid und Wasser entsteht – durch Energiezufuhr (Licht; Chlorophyll) – Traubenzucker (Glucose) – C6H12O6 und Sauerstoff. 3)
Alle Algen und grünen Landpflanzen verwenden ausschließlich Wasser (H2O) als Reduktionsmittel. Der im Wasser gebundenen Sauerstoff wird als Oxidationsprodukt des Wassers bei der sogenannten oxygenen Photosynthese als molekularer Sauerstoff (O2) freigesetzt. Der gesamte in der Erdatmosphäre und Hydrosphäre vorkommende Sauerstoff wird durch oxygene Photosynthese gebildet.
2. CO2-Inventar in der Atmosphäre 2)
Auf der Erde gibt etwa 75 Billiarden (=Millionen Milliarden) Tonnen Kohlenstoff. 99,8 % davon befindet sich im Gestein, fast alles als Karbonate im Kalkstein. Weiterer Kohlenstoff befindet sich in fossilen Brennstoffen( Kohle, Erdöl, Erdgas): 4.100 Mrd. t Kohlenstoff. Im Wasser: 38.000 Mrd. t Kohlenstoff = 0,05 % des gesamten Vorkommens Im Boden: 1.580 Mrd. t Kohlenstoff = 0,002 % des gesamten Vorkommens. In Lebewesen: 800 Mrd. t Kohlenstoff = 0,001 % des gesamten Vorkommens. In der Luft: 820 Mrd: t Kohlenstoff = 0,001 % des gesamten Vorkommens.
In der Atmosphäre sind somit insgesamt etwa 3.000 Mrd. t CO2 enthalten.
3. Wirkungsgrad und Produktivität der Photosynthese.3)
- Die für die Synthese von einem Mol Glucose benötigte Lichtenergie beträgt je nach Wellenlänge zwischen 1430 kJ (Blau) und 8064 kJ (Rot)
- Die Freie Reaktionsenthalpie für die Bildung von Glucose aus CO2 und H2O beträgt unter Standardbedingungen 2862 kJ/mol.
- Das ergibt einen Wirkungsgrad von 20,0 Prozent für blaues und 35,5 Prozent für rotes Licht.
|
gesamte Erde Fläche 0,51 x 1015 m2 80 x 109 t pro Jahr (100 %) |
|
|
|
davon Ozeane Fläche 0,36 x 1015 m2 28 x 109 t pro Jahr (35,4 %) |
|
|
|
davon Land Fläche 0,15 x 1015 m2 52 x 109 t pro Jahr (64,6 %) 4. Anwendung von CO2 in Gewächshäusern 4)Der normale CO2-Gehalt der Luft von 320 bis 360 vpm CO2 stellt für viele Pflanzen keinen optimalen Wert für die Photosynthese dar. Als für die Pflanzen optimale Werte werden CO2-Konzentrationen zwischen 600 bis 1600 vpm CO2 angegeben. Gemüsepflanzen verlangen tendenziell etwas höherer Werte als Zierpflanzen [ Sofern für die jeweilige Kultur keine Angaben zu optimalen CO2-Konzentrationen vorhanden sind, wird als Faustzahl ein Wert von 600 vpm CO2 angegeben, mit dem der Gärtner zunächst beginnen sollte. Begrenzt wird die maximal einstellbare CO2-Konzentration auch durch die maximale Konzentration am Arbeitsplatz, die zum Schutz der Arbeitskräfte eingehalten werden muss. Diese liegt bei 5000 vpm CO2. 5.Großtechnische Anwendung von CO2 in Gewächshäusern 5,6)5.1. Raffinerie- CO2 für 550 Gewächshäuser in den Niederlanden 5,) CO2CCCO2 für Gewächshäuser: 350.000 t CO2 strömen in den Niederlanden von der Shell- ÖlraffÖlRaffinerie bei Rotterdam über eine 85 km lange Transport-Pipeline und ein 300 km langesVlanges Verteilungsnetz an mehr als 550 Gewächshäuser. CO2 wird für die Photosynthese der Pflanzeder Pflanzen benötigt. Mit dem CO2 wird das Wachstum von Tomaten, Gurken und Salaten gefördert. 1.C5.O2 1.CO5.25.2. Luther-Tomate Wittenberg 6) Im Jahre 2014 entstand in Wittenberg eine einzigartige Komposition – die Luther-Tomate. Die Idee, die Idee,die Gewächshäuser direkt neben die SKW Stickstoffwerke Piesteritz zu platzieren, entstammt einem effizienten Gedanken: Bei der Produktion im Werk entstehen wichtige Abfallprodukte, wie CO2 und Wärme, die sonst ungenutzt in die Umwelt abgeschieden werden würden können jetzt genutzt werden.. Diese werden über Pipelines zu den Gewächshäusern transportiert. Ende des Jahres 2013 wurden fast 600.000 Tomatenstauden gepflanzt. / 6. Beispiele für die CO2-Nutzung in der Chemischen Industrie
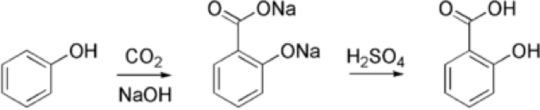
6.1. Harnstoffsynthese: 7) 2 Stufen – Reaktion: 2 NH3 + CO2 = NH2– CO-NH2 +H2O (Harnstoff + Wasser) Die industrielle Produktion von Harnstoff in einem Hochdruckverfahren geht auf Carl Bosch und Wilhelm Meiser zurück. Die BASF nahm 1922 die erste Produktionsanlage in Betrieb, bei der sich in einem Hochdruckreaktor im ersten Schritt bei 150 bar aus Ammoniak und Kohlenstoffdioxid in einer mit −117 kJ/mol exothermen Reaktion Ammoniumcarbamat (NH4CO2NH2) bildete, das in einer endothermen Reaktion mit +15,5 kJ/mol weiter zu Harnstoff und Wasser reagiert. Eine industrielle Verwendungsmöglichkeit von Harnstoff ist die Herstellung von Melamin, das z. B. mit Formaldehyd zu Kunstharzen verarbeitet wird, und von Harnstoff-Formaldehyd-Harzen (Harnstoffharz, so genannte UF-Harze), die z. B. zur Produktion von Spanplatten eingesetzt werden. Harnstoff ist ein viel genutzter Stickstoffdünger und Ausgangsstoff für die chemische Industrie, etwa für die Herstellung von Harnstoffharzen, die als Klebstoff, zur Imprägnierung oder Isolierung eingesetzt werden. Harnstoff dient als Grundlage für die Synthese von Barbitursäure, Koffein, Hydrazin und weiteren Chemikalien. Mit einem Produktionsvolumen von etwa 200 Millionen Tonnen pro Jahr ist Harnstoff eine der meisthergestellten Chemikalien. 6.2. Salicylsäure 8)9) Durch Umsetzung von CO2 mit Natrium-Phenolat wird mit der Kolbe-Schmitt-Reaktion Salicylsäure gewonnen.[
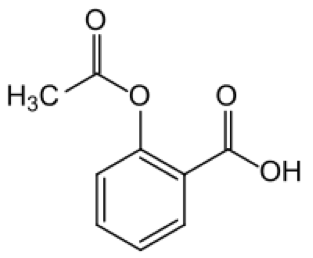
Durch Umsetzung von Salicylsäure mit Essigsäureanhydrid wird Aspirin erhalten.
Aspirin Salicylsäure dient zur Herstellung von Farb- und Riechstoffen und der Acetylsalicylsäure (ASS, besser bekannt unter dem Markennamen Aspirin), die als schmerzstillender, entzündungshemmender und gerinnungshemmender Arzneistoff Verwendung findet. 6.3. Methanol aus Synthesegas10) Die Dampfreformierung von Erdgas und die partielle Oxydation sind der Hauptlieferant für Synthesegas (CO,CO2 + H2 ).In Nordamerika und Europa wird meist Erdgas als Rohmaterial genutzt, in China und Südafrika basiert die Synthesegasherstellung auf Kohle oder Braunkohle. 2005 hat China 5,4 Millionen Tonnen Methanol erzeugt, davon 65 % oder 3,5 Millionen Tonnen auf Kohle basierend. Für die Bildung von Methanol aus Synthesegas können die folgenden Gleichungen formuliert werden: CO + 2 H2 = CH3OH und CO2 + 3 H2 = CH3OH + H2O C O 2 + 3 H 2 ⇌ C H 3 O H + H 2 O ; Δ H ( 300 K ) = − 49 , 5 k J / m o l {displaystyle mathrm {CO} _{2}+3;mathrm {H} _{2}rightleftharpoons mathrm {CH} _{3}mathrm {OH} +mathrm {H} _{2}mathrm {O} ; Delta H(300;mathrm {K} )=-49{,}5;mathrm {kJ} /mathrm {mol} } SHAPE * MERGEFORMAT Wegen ökonomischer Vorteile bei niedrigen Synthesedrücken und niedrigen Temperaturen wird Methanol größtenteils im Niederdruck-Verfahren produziert. Methanol hat einen großen Anwendungsbereich.. Mit 45 Millionen Tonnen Jahresproduktion (Stand: 2008) ist Methanol eine der meisthergestellten organischen Chemikalien. In der chemischen Industrie dient es insbesondere als Ausgangsstoff bei der Produktion von Formaldehyd (HCHO), Ameisensäure (HCOOH) und Essigsäure. (CH3COOH) Methanol und seine Folgeprodukte werden neben der stofflichen Verwendung auch als Energieträger eingesetzt. Mit der Technologie Methanol to Gasoline wird aus Methanol Kraftstoff. Methanol wird auch bei der Synthese von Biodiesel und dem Anti-Klopfschutzmittel MTBE (Methyl-t butylether, hergestellt aus Methanol + Isobuten) benötigt. In Brennstoffzellen kann Methanol als Wasserstofflieferant dienen. 6.4. Carbon2Chem von Evonik 11) Evonik zusammen mit mit 7 Partnern aus Industrie , Wissenschaft und Forschung wollen 20 Mio. t CO2 aus der Stahlbranche wirtschaftlich nutzbar machen für Dünger , Kraft- und Kunststoffe. Evonik bringt seine Katalysekompetenz in das Projekt ein, das vom Bundeswirtschaftsministerium mit über 60 Mio € gefördert wird. 6.5. Klimagas CO2 wird zu Weichschaum 12)13) In Dormagen wurde eine Anlage der Firma Covestro in Betrieb genommen, die rund 20 Gew.% CO2 aus Abgasen des Chemieparkes in ein Vorprodukt von Polyurethan-Weichschaum einbaut. Die 15 Mio € teure Prototyp-Anlage ist für 5000t Polyöl pro Jahr ausgelegt. Bereits 2010 hat das Bundesforschungsministerium ein Projekt mit 4,5 Mio € gefördert für die Nutzung von CO2 aus dem Rauchgas der Braunkohlekraftwerke.. Im Innovationszentrum beim Braunkohlekraftwerk Niederaußem betreibt RWE eine Pilotanlage zur CO2-Wäsche ,die das Kohlendioxid aus dem Rauchgas abtrennt. Mit diesen Ausführungen ist dargelegt, daß die Verteufelung von CO2 als Klimagas falsch und eine Lüge ist. CO2 ist vielmehr ein wichtiger Rohstoff für die Pflanzen, die Landwirtschaft und auch für die Chemie . Deshalb ist es zu begrüßen, daß es jetzt mehrere Initiativen zur CO2-Anwendung mit staatlicher Unterstützung gibt. Literatur 1.https://de.wikipedia.org/wiki/Photosynthese 2.http://www.oekosystem-erde.de/html/kohlenstoffkreislauf.html 3. http://.chemie.de/lexikon/Photosynthese.html 4.www.hortipendium.de/CO2-Düngung Nov.2013 5. http://www.the-linde- group.com/de/clean_technology/clean_technology_portfolio/co2_applications/greenhouse_supply/index.html 6.http://wittenberg-gemuese.de/unternehmen/ 7. https://de.wikipedia.org/wiki/Harnstoff#Herstellung 8. https://de.wikipedia.org/wiki/Kohlenstoffdioxid#Verwendung 9. https://de.wikipedia.org/wiki/Salicyls%C3%A4ure#Eigenschaften_und_Verwendung 10.. https://de.wikipedia.org/wiki/Methanol 11.Zeitschrift Folio (Evonik) Sept.2016, S.7 12.. Klimagas CO2 wird zu Weichschaum VDI-Nachr. 17.6.2016, S.16 13 www.rwe.com Pressemitteilung 15.9.2010.. |